この記事では「治験の種類をわかりやすく解説!臨床研究との違いやSADとMADとは?」ということでお伝えします。
あなたは、お医者さんに処方される薬がどのような段階を経てあなたの手元に届くかわかりますか?
実は、想像もつかないような期間や費用をかけて、製薬会社はその薬を開発しているのです。
そして、薬を開発するための試験(臨床試験)のことを一般的には治験と呼びます。
”治験バイト”というような言葉もあるぐらいなので、もしかしたらあなたも”治験”という言葉は聞いた事があるかもしれません。
この記事では、治験に関する大まかな説明をするとともに、あなたの薬が手元にとどくまでに必要な治験の種類や費用を説明します。
臨床研究と治験の違いもわかりやすく説明します!
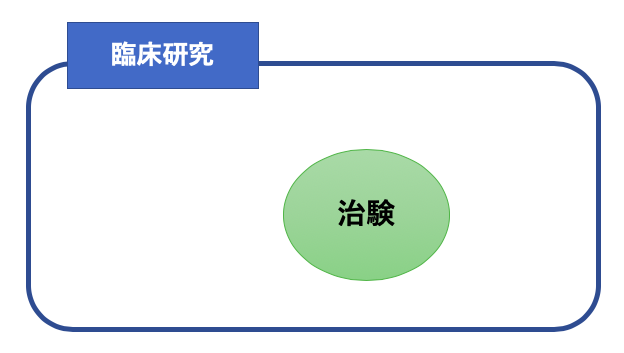
治験とは?臨床研究との違いは何?

治験を一言でいうと、こう説明できます。
”薬を開発する目的で”というところがポイントですね。
一方の臨床研究はというと、このように言う事ができます。
臨床研究は”薬を開発する目的”ではないこと。
そして、”新規にデータを得る事が目的で、何かしらを投与しなくてもいい”ということがさらなるポイントです。
そのため、臨床研究という大きな研究のなかの一つに、治験がある。
というイメージでいいです。
治験の期間と費用:薬ができるまでにどれだけのコストが必要なの?

お医者さんに処方され、あなたの手元に届いた薬。
これが開発されるまでにどれだけの期間と費用が必要なのでしょうか。
治験が最後まで実施され薬として販売される成功確率:3万分の1
この”3万分の1”という数字は、シーズ(薬と思われる実験段階の化合物)が発見されてから、その化合物が実際に承認される割合を示しています。
医薬品開発にかかる費用は年々増加の一途をたどっています。
その理由の一つとしては、原因が分かっている疾患に対する薬剤がすでに出尽くしているということ。
20世紀の薬の開発は、主に抗菌薬であったり、慢性疾患に対する薬が主でした。
抗菌薬であれば、菌が原因である事がすでにわかっています。
それに対する薬を開発すれば良いだけでした。
しかし今では、原因がわからない疾患に対する薬の開発が求められています。
そのため、失敗する薬の数が多くなり、開発費は年々増加しているのです。
治験を含め薬を開発するまでの費用:500億円
この500億円という数字は、現在(2016年)の、一つの薬剤を開発するための費用と言われています。
先に500億円をかけて薬を開発し、その後の特許期間にこれらの開発費を回収しなければなりません。
医薬品には特許があり、その期間は独占的な製造販売が可能になります。
しかしそれ以降は、いわゆる”ジェネリック医薬品”が作られるようになります。
そのため、新薬を開発するメーカーは特許期間に開発費を回収しなければならないのです。
そして、継続的に利益を確保していくためには、年に2つ程度の新薬を販売していく必要があると言われています。
しかし、2つの新薬開発に必要な年間5000億円の研究開発費を毎年捻出できる企業は少ないのが現状です。
特に、日本のメーカーではほぼ不可能な数値です。
他の工業製品では研究開発費用の割合が全体の5%程度であるのに対し、医薬品業界は20%前後の研究開発費が必要になります。
それぐらい先行投資する必要がある工業製品ということが分かります。
薬の開発期間:10年
一般的に、研究段階で薬の種(シーズ)が発見され販売されるまで、10年以上かかると言われています。
では、薬の開発にはどのような段階があるのでしょうか?
大きく分けると、以下のような段階があります。
- 基礎研究段階
- 非臨床試験段階
- 臨床試験段階
- 申請段階
- 承認
それぞれ、どのような段階かを見てみましょう!
基礎研究段階
基礎研究とは、薬になりそうな化合物を見つける段階です。
基礎研究段階では実際の生き物を使わず、細胞などでその化合物の活性などを調べる段階です。
非臨床試段階験
非臨床試験とは、基礎研究で見つけた化合物を、実際にマウス、ラット、ウサギ、イヌ、マカク(サルの一種)などの動物に投与して、その有効性や安全性を確認する段階です。
「臨床」」という単語は医療において「現場」、あるいは「現場を重視する立場」という意味です。
動物段階での確認は、医療の「現場」ではありませんので、非臨床、という言葉が使われます。
臨床試験段階(治験段階)
そして、非臨床試験をパスした化合物が臨床試験段階に移ります。
この臨床試験では実際にヒトに投与してその有効性や安全性を確認するという段階になります。
臨床試験は大きく分けて3段階に分かれています。
初期段階では主に薬の安全性を確認し、後半で有効性を確認することになります。
申請段階
臨床試験でその化合物の有効性や安全性を確認出来た時に、承認申請段階に入ります。
この段階では厚労省直下の独立行政法人である、医薬品医療機器総合機構(PMDA)が、申請販売するのに十分な試験を違いなく実施しているかなどを確認します。
今までの基礎研究段階から臨床試験段階までのデータとその結果が報告されている報告書を作成して申請します。
これらを全てパス出来たものだけが、実際に薬として販売されるのです。
治験の種類はどれぐらいある?SADやMADって何?
治験(臨床試験)とは、薬を開発する目的で、薬を人に投与してその有効性と安全性を確かめる試験のことでした。
そして、あなたの手元に処方されるまでに、10年以上、500億円をかけて開発される事がわかりました。
では、治験にはどれだけの種類があるのでしょうか?
一口に”治験”と言っても、様々な種類の試験があります。
例えば、健康成人に投与する試験、患者さんに投与する試験、腎機能や肝機能が低下している患者さんに投与する試験など、様々な試験があります。
その試験が何を目的にするかによって、第I相試験、第II相試験、第III相試験、臨床薬理試験などと呼ぶことがあります。
それぞれの試験の概要を見てみましょう。
治験の種類:第I相試験の概要(SAD、MAD)
第I相試験は、健康成人の被験者さんに協力してもらって、その薬剤の薬物動態、安全性及び忍容性を確認する段階です。
(抗がん剤など、毒性の強い薬に関しては、第I相試験から患者さんで治験する場合があります。)
その試験のデザインによって、単回投与試験(SAD;Single Ascending Dose)や反復投与試験(MAD;Multiple Ascending Dose)などと呼びます。
SADの読み方は、サドやサッドのどちらかで呼びます。
MADの読み方も、マドやマッドのどちらかで呼びます。
非臨床で確認された、毒性が出る用量の何十分の一、何百分の一の用量で試験をしていきます。
第I相試験では、最も少ない用量から安全性が確認でき次第、次の用量の試験をするという、用量漸増法という方法を用います。
用量の上げ方は、大体3の公比で上げていくことが多いです。
つまり、0.3mg → 1.0mg → 3.0mgという感じです。
第I相試験ではなぜ健康成人に投与するのか?
第I相試験では、まず健康成人に投与します。
この理由としては、何か有事のことがあったときに、健康成人の方が治癒しやすいということが挙げられます。
第I相試験では、世界で初めてヒトに投与する試験でもあるため、万が一を想定した試験を組む必要があります。
人に投与する前までに、安全性は動物実験でかなりの期間をかけてデータを蓄積しています。
そのため、本当に”安全だろう”と会社も国も確認した段階で人に投与されます。
しかし、動物と人との種類の違いによって、万が一の事が想定されるのです。
第I相試験でおきた過去の悲劇
第I相試験で有名な悲劇としては、2006年に第I相試験が実施された「TGN1412」というモノクローナル抗体が有名です。
6人の健康ボランティアに使用され6人全員が、直後から全身の痛みや呼吸困難を訴え、意識がなくなり1時間後には多臓器不全のためICUに入院したという事件でした。
このように、安全性を担保して実施することが大前提ですが、それでも完全に安全である保障はできないのが臨床試験です。
治験の種類:第II相試験の概要
第II相試験は、第I相試験で確認できた用量の範囲の中で、今度は患者さんを対象として用量の反応性を確認する試験です。
容量の反応性とは、有効性や安全性を指しています。
この中で、リスクベネフィットが一番良い用量を採用して第III相試験に移行します。
第II相試験は反復投与が基本で、薬剤のの半減期などを考慮して定常状態になるまでの期間、反復投与されることが多いです。
第II相試験で重要なPoCという概念
第II相試験は、基礎的な研究で予想された薬の効果が、実際に動物またはヒトへの投与試験により証明されるかどうか?ということも確認されます。
これをProof of Concept(PoC;ポック)と呼びます。そのため、第II相試験は倫理的に許される限り、単剤での試験を実施します。
色々な種類の第II相試験
第II相試験には、単剤での用量反応試験を中心として、様々な試験の仕方が考えられます。
例えば、PoCを取るために単剤で試験を実施しますが、その疾患では様々な薬剤を併用することが多い場合には、併用した時の新薬の有効性や安全性はどうか?といった試験を実施することも考えられます。
第III相試験で採用する用法用量を探索するというイメージ
第II相試験は様々な内容の試験方法が考えられます。そのため、ひとくくりにすることが出来ないのですが、イメージとしては、第III相試験で採用する用法用量(レジメン)を確認することを目的とするのが第II相試験です。
そして、第II相試験で探索的に確認されたレジメンを用いて、第III相試験で検証するという流れになります。
治験の種類:第III相試験の概要
第III相試験とは、その薬剤の有効性と安全性を確立する試験です。
そのため、この試験で設定した主要評価項目(プライマリーエンドポイント)について、比較対象との統計的な検証が求められます。
そのため、この試験での統計の役割はすごく重要になってきます。
主要評価項目としては、有効性の項目を設定することが多く、症例数も主要評価項目に基づいて設定します。
そして、統計解析計画書(SAP)も作成手順が重要になりますね。
第III相試験は同じ試験を二つ実施しなければならない?
アメリカの薬剤の審査機関であるFDAは、第III相試験を同じデザインで2つ実施することを求めています。
この第III相試験が2つとも主要評価項目を達成すれば、ほぼ間違いなく薬剤は承認されます。
もし1つだけしか達成できなかった場合には、その後の審査の段階で色々と説明をする必要があります。
ただし、これはその薬剤がターゲットとする患者数にも依存するため、例えば、患者巣が少ない疾患であれば、1つの第III相試験だけで承認されることも多いです。
治験では安全性の検証は難しい
第III相試験であっても、安全性に対する検証は不可能です。
それは有害事象や副作用の発生率の低さと、その発生率に対する検証のための症例数がとても必要になるからです。
そのため、第III相試験では確認しきれなかった安全性に対する確認を、承認後に求めることが多いです。
これが全例調査というもので、最低何例は確認しなさい、という当局からの宿題になります。
その他の治験の種類
上記の治験を経て、薬は開発されます。
しかし、これらの治験以外にも、特殊な治験が存在します。
その他の治験:製造販売後臨床試験の概要
特殊な治験の一例が、製造販売後臨床試験です。
製造販売後臨床試験(市販後臨床試験)とは、読んで字のごとく、薬剤が販売された後に実施する試験です。
販売されたのに、今更なにを試験するの?と思う方もいらっしゃると思いますが、実はこの試験が薬剤の売り上げを左右することになる可能性があります。
まずは製造販売後臨床試験の定義を見てみます。
製造販売後臨床試験とは、製造販売後調査等のうち、製造販売業者等が、治験若しくは使用成績調査の成績に関する検討を行った結果得られた推定等を検証し、又は診療においては得られない品質、有効性及び安全性に関する情報を収集するため、当該医薬品について承認された効能・効果及び用法・用量に従い行う(臨床)試験
・・・さっぱり分からないですね。
製造販売後臨床試験を行う目的
定義から考えるより「なぜ企業が製造販売後臨床試験を行うか?」という目的から考えてみましょう。
結論から言いますと、製造販売後臨床試験を行う目的は「その薬剤に付加価値を与える情報を得る」ということです。
どういうことかを、風邪薬の例を用いて解説してみます。
風邪薬は複数の会社から多くの種類が出ています。
その際に、自分たちの薬剤をどのように他社の薬剤と差別化できるでしょうか?
それはやはり、付加価値のあるデータを取る、ということです。
風邪薬であれば、風邪を早く治せると証明できれば、販売の承認を得ることが出来ます。
しかし患者さん目線で考えた時に、同じような有効性がある2つの薬剤に関して、「眠くなりにくい風邪薬」と「眠気が必ず起こる風邪薬」では、どちらを選ぶでしょうか?
90%ぐらいの患者さんが「眠くなりにくい風邪薬」を選ぶのではないかと思います。
ただし治験では、眠くなりにくいということを証明したとしても、風邪が治らなければ風邪薬として承認されません。
そのため、治験ではちゃんと風邪薬としての有効性を証明し、製造販売後臨床試験で差別化ポイント(この例では眠気)のデータを取得していくのです。
製造販売後臨床試験での制約
製造販売後臨床試験は治験と違って、制約があります。
それは、承認された患者集団にしか投与できず、かつ承認された用法用量でしか投与が出来ないということです。
つまり、風邪薬の製版後臨床試験であれば、風邪をひいていない人で試験は出来ず、1日3回1錠の用法用量で承認されているのであれば、その用法用量から変更してはいけません。
製造販売後臨床試験で得たデータはどう使われるか?
冒頭で、製造販売後臨床試験が薬剤の売り上げを左右することになる可能性があります、と書きました。
この試験のデータによってその疾患の治療ガイドラインの位置付けが変わることがあり、他の薬剤との差別化につながるためです。
また、製造販売後臨床試験で得たデータを基に新たな適用拡大に向けた治験を開始することも、十分に考えられることです。
治験とは?まとめ

あなたの手元に処方された薬。
それは、10年以上500億円以上をかけて開発されたものです。
そして治験には、様々な種類がありました。
それらを経て、有効性と安全性が十分であったものだけがあなたの手元にあるのです。







コメント
コメント一覧 (3件)
[…] […]
[…] 第I相試験、第II相試験、第III相試験です。 […]
[…] >>治験の種類は何がある?臨床研究との違いは? […]